ภาพที่ 1. กลไกการทำงานของ RNA interference.
(ที่มา Bumcrot D et. al, Nat Chem Biol. 200619)
บทนำ
การ ยับยั้งการแสดงออกของยีนที่ระดับอาร์เอ็นเอ หรืออาร์เอ็นเอไอ (RNA interference หรือ RNAi) เป็นกระบวนการยับยั้งการทำงานของยีนโดยการแทรกแซงอาร์เอ็นเอ (RNA) ด้วยอาร์เอ็นเอสายคู่ (double-stranded RNA; dsRNA) ที่มีความจำเพาะเจาะจง. กระบวนการนี้ถูกค้นพบเมื่อปี พ.ศ. 2541 โดยนักวิทยาศาสตร์สองท่านคือ ศ.ดร. แอนดริว ไฟร์ (Andrew Z. Fire) จากมหาวิทยาลัยสแตนฟอร์ด (Stanford University) ในมลรัฐแคลิฟอร์เนีย และ ศ.ดร. เคร็ก เมลโล (Craig Mello) จากโรงเรียนแพทย์แห่งมหาวิทยาลัยแมสซาชูเซ็ตต์ (The University of Massachusetts Medical School) ของสหรัฐอเมริกา1 โดยเมื่อปี พ.ศ. 2549 พวกเขาได้รับรางวัลโนเบลสาขาการแพทย์และสรีรวิทยา.
ปัจจุบัน ได้มีการวิจัยประโยชน์ด้านการรักษาด้วย RNAi.
กลไกการทำงานของ RNA interference1-4
หลัก การทำงานสำคัญของ RNAi ในการยับยั้งการแสดงออกของยีนแล้วส่งผลให้เกิดการยับยั้งการผลิตโปรตีนเป้า หมาย คือการแทรกแซง messenger RNA (mRNA) บนยีนเป้าหมาย ด้วยอาร์เอ็นเอสายคู่ ซึ่งออกแบบให้มีความจำเพาะเจาะจงต่อสาย mRNA เป้าหมาย (target mRNA) แล้วส่งผลให้สาย mRNA เหล่านั้นถูกทำลายและหยุดการสร้างโปรตีนในที่สุด.
กลไกการทำงานของ RNAi (ภาพที่ 1) เริ่มต้นจากการที่อาร์เอ็นเอสายคู่ที่ได้จากการสังเคราะห์ขึ้นอย่างจำเพาะ เจาะจงต่อสาย mRNA เป้าหมายถูกนำส่งเข้าไปภายในเซลล์ แล้วถูกตรวจจับโดยเอนไซม์ ribonuclease ชื่อว่า Dicer ทำให้ได้อาร์เอ็นเอสายคู่ขนาดสั้น (21-25 นิวคลิโอไทด์) เรียกว่า small interfering RNAs (siRNAs). จากนั้น siRNAs เหล่านี้จะถูกแยกสายออกจากกันและรวมตัวกับโปรตีนหลายชนิดเกิดเป็นสารประกอบ เชิงซ้อนขนาดใหญ่ เรียกว่า RNA-induced silencing complex (RISC) โดยสารประกอบเชิงซ้อนนี้จะทำหน้าที่ตรวจจับสาย mRNA เป้าหมายแล้วย่อยสาย mRNA เหล่านั้นให้มีขนาดเล็กลงโดยเอนไซม์ endonuclease ที่อยู่ภายใน RISC ทำให้เกิดการสลายตัวของสาย mRNA เป้าหมายซึ่งเป็นโมเลกุลสำคัญในการนำรหัสพันธุกรรมจากดีเอ็นเอเพื่อ สังเคราะห์โปรตีน ซึ่งส่งผลให้เกิดการยับยั้งกระบวนการแสดงออกของ ยีน และการสร้างโปรตีนเป้าหมายภายในเซลล์ ซึ่งเรียกกระบวนการนี้ว่า post-transcriptional gene silencing หรือ gene silencing.
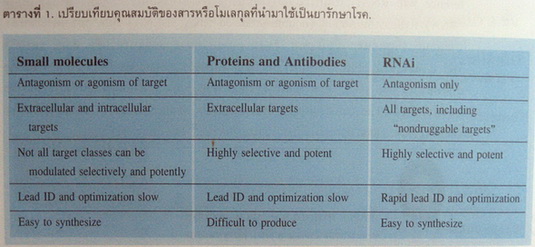
บทบาทของ RNA interference ในทางการแพทย์ (ตารางที่ 1)
โรคที่มีการศึกษาโดยนำเทคนิค RNAi มาประยุกต์ใช้นั้น ได้แก่ โรคมะเร็ง โรคติดเชื้อ และโรคในระบบทางเดินหายใจ
1. โรคมะเร็ง (cancer)
ความสำเร็จในการคิดค้นยา Imatinib (Gleevec ®) เพื่อรักษา chronic myelogenous leukemia โดยออกฤทธิ์ยับยั้งอย่างจำเพาะต่อการทำงานของเอนไซม์ tyrosine kinase ที่ BCR-ABL proto-oncogene จัดว่าเป็นกลไกการกำจัดเซลล์มะเร็งโดยตรงที่มีประสิทธิภาพสูง.5 อย่างไรก็ตาม การเกิดภาวะดื้อต่อยามะเร็งยังคงเป็นปัญหาสำคัญ เมื่อเกิดการผ่าเหล่า (mutation) ของโปรตีน BCR-ABL fusion protein ส่งผลให้ยา Imatinib ไม่สามารถจับกับโปรตีนดังกล่าวบนตำแหน่ง tyrosine kinase ได้. การนำเทคนิค RNAi มาใช้ประโยชน์ในการแก้ปัญหาดังกล่าวจึงได้ทดลองโดยยับยั้งการแบ่งตัวของ transformed haematopoietic cells ซึ่งมีเป้าหมายทำลายการสร้างโปรตีน BCR-ABL โดยตรงและยับยั้งการเกิดการผ่าเหล่าของโปรตีน6 วิธีดังกล่าวจัดว่าเป็นการยับยั้งการทำงานของโปรตีนได้อย่างจำเพาะเจาะจงและมีประสิทธิภาพเพื่อกำจัดเซลล์มะเร็ง.
เทคนิค RNAi ยังสามารถนำมาใช้ยับยั้ง การทำงานของตัวรับ (receptor) ในกระบวนการนำส่งสัญญาณภายใน (cell signaling pathway) ซึ่งเซลล์มะเร็งใช้ในการเจริญเติบโต รายงานการใช้ RNAi เพื่อยับยั้งการทำงานของ chemokine receptor chemokine (C-X-C motif) receptor 4 (CXCR4) ใน breast cancer cell line ชนิด MDA-MB-231 พบว่าการยับยั้งการทำงานของ CXCR4 ด้วยวิธีนี้สามารถลดอัตราการเจริญเติบโตของเซลล์มะเร็ง เต้านมได้อย่างมีนัยสำคัญ.7
การยับยั้งและควบคุมการทำ งานของโปรตีนสำคัญๆ หลายชนิดที่เกี่ยวข้องกับการเกิดโรคมะเร็งแบบจำเพาะเจาะจงจัดเป็นอีกเป้า หมายหนึ่งของการออกแบบยารักษาโรคมะเร็ง ดังนั้นเทคนิค RNAi จึงเข้ามามีบทบาทสำคัญในการรักษาโรคดังกล่าว. รายงานการศึกษาโดยวิธียับยั้งการทำงานของโปรตีน clusterin ซึ่งเป็น antiapoptotic protein ที่พบมากในเซลล์มะเร็งจัดว่าเป็นกลไกหนึ่งของการรักษาด้วยเคมีบำบัด (chemotherapy) แต่การรักษาด้วยวิธีเคมีบำบัดนี้ทำให้เกิดความไม่จำเพาะต่อโปรตีนเป้าหมาย การยับยั้งการทำงานของโปรตีน clusterin ด้วย RNAi จึงเป็นกลวิธีใหม่ในการรักษา รายงานการศึกษาในเซลล์มะเร็งปอดเพาะเลี้ยงชนิด A549 พบว่า siRNA สามารถยับยั้งการทำงานของโปรตีน clusterin ได้ดีและมีผลเพิ่ม chemosensitivity ของเซลล์อีกด้วย.8 นอกจากนี้ การศึกษาการทำงานของโปรตีนเป้าหมายชนิดอื่นๆ ที่มีการแสดงออกสูงมาก (over- expression) ในเซลล์มะเร็ง ได้มีรายงานวิจัยหลายชิ้น ซึ่งใช้เทคนิค RNAi เพื่อยับยั้งการทำงานของโปรตีนเหล่านี้ ได้แก่ multidrug resistance protein, telomerase และ Bcl-2.9-11
2. โรคติดเชื้อ (infectious diseases)
การ คิดค้นและพัฒนายาใหม่เพื่อใช้ในการรักษาโรคติดเชื้อในปัจจุบัน ได้อาศัยฐานข้อมูลของลำดับเบสบนยีนก่อโรคที่สำคัญต่างๆ ในจีโนมของไวรัสและแบคทีเรีย การรักษาโรคติดเชื้อที่เกิดจากไวรัสนั้นมีเป้าหมายไปยับยั้งการทำงานของยีน ที่มีหน้าที่สำคัญในการจำลองตัว (replication) ของไวรัส. นอกจากนั้น ยังมีเป้าหมายในการยับยั้งการเข้าสู่เซลล์เจ้าบ้าน (host cells) จากไวรัส รวมถึงการยับยั้งการเจริญเติบโตของไวรัสในเซลล์เจ้าบ้านอีกด้วย. การยับยั้งการทำงานของยีนก่อโรคเหล่านี้ด้วยวิธี RNAi ได้มีการศึกษาในโรคติดเชื้อไวรัสหลายชนิด ได้แก่ HIV, hepatitis และ severe acute respiratory syndrome (SARS)-associated coronavirus 12-14 การ ศึกษาการยับยั้งการทำงานของเอนไซม์ SARS viral polymerase ซึ่งทำหน้าที่สำคัญในการจำลองตัว (replication) ของ coronavirus ด้วยวิธี RNAi พบว่าวิธีดังกล่าวสามารถยับยั้งการสร้าง mRNA และโปรตีนซึ่งใช้ในการจำลองตัวของไวรัสชนิดนี้ได้ดี.15
การ นำ RNAi มาใช้ในการรักษาโรคติดเชื้อปรสิต ได้มีรายงานการศึกษาที่น่าสนใจโดยเฉพาะอย่างยิ่งการรักษาโรคมาลาเรีย ซึ่งมักพบปัญหาสำคัญ คือการดื้อต่อยารักษาโรค. ดังนั้นการนำเทคนิค RNAi มาประยุกต์ใช้ในการรักษาโรคคาดว่าจะเป็นวิธีการสำคัญหนึ่งในการรักษา Kumar และคณะ16 ได้ศึกษาการยับยั้งการทำงานของเอนไซม์ PP1 serine/threonine protein phosphatase ซึ่งเป็นเอนไซม์สำคัญในการควบคุมวัฏจักรชีวิต (life cycle) ของเชื้อมาลาเรียและเป็นเอนไซม์ที่พบได้ทุกสายพันธุ์ของเชื้อมาลาเรีย พบว่า siRNA ที่สังเคราะห์ขึ้นเพื่อยับยั้งการทำงานของโปรตีนนี้ส่งผลยับยั้งการสร้างสาย ดีเอ็นเอของเชื้อมาลาเรีย.
3. โรคในระบบทางเดินหายใจ (respiratory diseases)
การ ค้นพบและพัฒนา antisense oligonucleotides ชนิดพ่นเข้าสู่ปอด จัดว่าเป็นผลิตภัณฑ์รูปแบบใหม่ของการรักษาโรคในระบบทางเดินหายใจ เช่น โรคหอบหืด โรคทางเดินหายใจอุดตันเรื้อรัง (chronic obstructive pulmonary disease; COPD)17 ซึ่งมีการผลิตออกจำหน่ายในท้องตลาด. การประยุกต์ใช้เทคนิค RNAi ในการรักษาโรคในระบบทางเดินหายใจเพื่อยับยั้งการสร้างโปรตีนที่เกี่ยวข้อง ได้มีรายงานในเซลล์เพาะเลี้ยงชนิด NCI-H292 human airway epithelial cells. การทดลอง ใช้ siRNA เพื่อยับยั้งการสร้างสาร transforming growth factor (TGF)-alpha ซึ่งเป็นสารสื่อสำคัญที่ช่วยให้ globlet cell มีการเจริญเติบโตอย่างรวดเร็วทำให้เกิดการผลิตสารเมือก (mucus) ออกมาจำนวนมากในโรคทางเดินหายใจอุดตันเรื้อรัง (COPD) พบว่าวิธีดังกล่าวสามารถลดการสร้างสารเมือกและส่งผลลดการแสดงออกของ epidermal growth factor receptor (EGFR) ในเซลล์ดังกล่าว.18
บทสรุป
การ ศึกษาและวิจัยเพื่อพัฒนายาใหม่ในปัจจุบัน ได้นำความรู้และเทคนิคทางด้านอณูชีววิทยา (molecular biology) มาประยุกต์ใช้เพื่อการออกแบบยาให้มีความจำเพาะเจาะจงต่อยีนก่อโรคมากขึ้น ซึ่งเทคนิค RNAi ได้เข้ามามีบทบาทสำคัญในการยับยั้งการแสดงออกของยีนเป้าหมายทำให้การ สังเคราะห์โปรตีนภายในเซลล์ถูกยับยั้ง. อย่างไรก็ตาม เทคนิค RNAi ยังมีข้อควรพิจารณาในหลายประเด็นเช่นความคงตัว (stability) ระบบการนำส่ง (delivery) และความไม่จำเพาะเจาะจง (off-target effect) ของ siRNA เมื่อเข้าสู่ร่างกาย. ดังนั้น การพัฒนาผลิตภัณฑ์ยาจาก RNAi ในปัจจุบันยังอยู่ในขั้นตอนการศึกษาวิจัยทางคลินิกในมนุษย์ ซึ่งคาดว่าในอนาคต ผลิตภัณฑ์เหล่านี้จะเป็นทาง เลือกใหม่ในการรักษาโรคหลายชนิดได้อย่างมีประสิทธิภาพ.
เอกสารอ้างอิง
1. Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 1998 Feb 19;391(6669):806-11.
2. Bernstein E, Caudy AA, Hammond SM, Hannon GJ. Role for a bidentate ribonuclease in the initiation step of RNA interference. Nature 2001 Jan 18;409(6818):363-6.
3. Caudy AA, Ketting RF, Hammond SM, Denli AM, Bathoorn AM, Tops BB, et al. A micrococcal nuclease homologue in RNAi effector complexes. Nature 2003 Sep 25;425(6956):411-4.
4. Lee Y, Ahn C, Han J, Choi H, Kim J, Yim J, et al. The nuclear RNase III Drosha initiates microRNA processing. Nature 2003 Sep 25;425(6956):415-9.
5. Deininger M, Buchdunger E, Druker BJ. The development of imatinib as a therapeutic agent for chronic myeloid leukemia. Blood 2005 Apr 1;105(7):2640-53.
6. Chen J, Wall NR, Kocher K, Duclos N, Fabbro D, Neuberg D, et al. Stable expression of small interfering RNA sensitizes TEL-PDGFbetaR to inhibition with imatinib or rapamycin. J Clin Invest 2004 Jun;113(12):1784-91.
7. Lapteva N, Yang AG, Sanders DE, Strube RW, Chen SY. CXCR4 knockdown by small interfering RNA abrogates breast tumor growth in vivo. Cancer Gene Ther 2005 Jan;12(1):84-9.
8. July LV, Beraldi E, So A, Fazli L, Evans K, English JC, et al. Nucleotide-based therapies targeting clusterin chemosensitize human lung adenocarcinoma cells both in vitro and in vivo. Mol Cancer Ther 2004 Mar;3(3):223-32.
9. Stege A, Priebsch A, Nieth C, Lage H. Stable and complete overcoming of MDR1/P-glycoprotein-mediated multidrug resistance in human gastric carcinoma cells by RNA interference. Cancer Gene Ther 2004 Nov;11(11):699-706.
10. Yin ZH, Ren CP, Li F, Yang XY, Li H, Zhao M, et al. Suppression of bcl-2 gene by RNA interference increases chemosensitivity to cisplatin in nasopharyngeal carcinoma cell line CNE1. Acta Biochim Biophys Sin (Shanghai) 2004 Nov;36(11):749-53.
11. Li S, Crothers J, Haqq CM, Blackburn EH. Cellular and gene expression responses involved in the rapid growth inhibition of human cancer cells by RNA interference-mediated depletion of telomerase RNA. J Biol Chem 2005 Jun 24;280(25):23709-17.
12. Dave RS, Pomerantz RJ. Antiviral effects of human immunodeficiency virus type 1-specific small interfering RNAs against targets conserved in select neurotropic viral strains. J Virol 2004 Dec;78(24):13687-96.
13. Wilson JA, Jayasena S, Khvorova A, Sabatinos S, Rodrigue-Gervais IG, Arya S, et al. RNA interference blocks gene expression and RNA synthesis from hepatitis C replicons propagated in human liver cells. Proc Natl Acad Sci U S A. 2003 Mar 4;100(5):2783-8.
14. Zhang Y, Li T, Fu L, Yu C, Li Y, Xu X, et al. Silencing SARS-CoV Spike protein expression in cultured cells by RNA interference. FEBS Lett 2004 Feb 27;560(1-3):141-6.
15. Wang Z, Ren L, Zhao X, Hung T, Meng A, Wang J, et al. Inhibition of severe acute respiratory syndrome virus replication by small interfering RNAs in mammalian cells. J Virol 2004 Jul;78(14):7523-7.
16. Kumar R, Adams B, Oldenburg A, Musiyenko A, Barik S. Characterisation and expression of a PP1 serine/threonine protein phosphatase (PfPP1) from the malaria parasite, Plasmodium falciparum: demonstration of its essential role using RNA interference. Malar J 2002 Apr 26;1:5.
17. Ball HA, Sandrasagra A, Tang L, Van Scott M, Wild J, Nyce JW. Clinical potential of respirable antisense oligonucleotides (RASONs) in asthma. Am J Pharmacogenomics 2003;3(2):97-106.
18. Shao MX, Nakanaga T, Nadel JA. Cigarette smoke induces MUC5AC mucin overproduction via tumor necrosis factor-alpha-converting enzyme in human airway epithelial (NCI-H292) cells. Am J Physiol Lung Cell Mol Physiol 2004 Aug;287(2):L420-7.
19. Bumcrot D, Manoharan M, Koteliansky V, Sah DW. RNAi therapeutics : a potential new class of pharmaceutical drugs. Nat Chem Biol 2006 Dec;2(12):711-9.
อัจฉรา ศรีสดใส ภ.บ., ปร.ด., อาจารย์
คณะเภสัชศาสตร์ มหาวิทยาลัยขอนแก่น
ไม่มีความคิดเห็น:
แสดงความคิดเห็น